近日我校hjc356黄金城首页线路中西秀树教授团队青年教师柳艺石在GPI锚定蛋白生物合成调控机制的研究方面取得新进展,通过全基因组CRISPR–Cas9筛选,发现广泛表达的GPI锚定蛋白CD55前体和内质网驻留蛋白ARV1参与GPI的上调。研究首次阐明细胞维持GPI与蛋白前体平衡的分子机制。研究成果“Accumulated precursors of specific GPI-anchored proteins upregulate GPI biosynthesis with ARV1”发表于细胞生物学领域著名期刊Journal of cell biology(J. Cell Biol.https://doi.org/10.1083/jcb.202208159)。
糖基磷脂酰肌醇(GPI)锚定化修饰作为真核细胞蛋白质糖基化修饰的重要方式之一,在细胞分化和生长、发育、信号传导、免疫以及受精过程中发挥重要作用。人体细胞中超过150种蛋白质被GPI修饰,包括酶、补体、配体和免疫调节因子等。大量研究发现,GPI锚定蛋白的异常表达与癌症和神经退行性疾病相关。因此,深入探究GPI锚定蛋白生物合成调控机制具有重要的生理学意义。GPI锚定蛋白的生物合成起始于内质网,经由高尔基体,最终表达到细胞膜表面。前期研究中,团队发现GPI的合成受到了内质网相关降解途径(ERAD)的调节。在ERAD途径缺陷的细胞中,GPI的合成上调,推测存在调控GPI合成的蛋白因子(图1)。
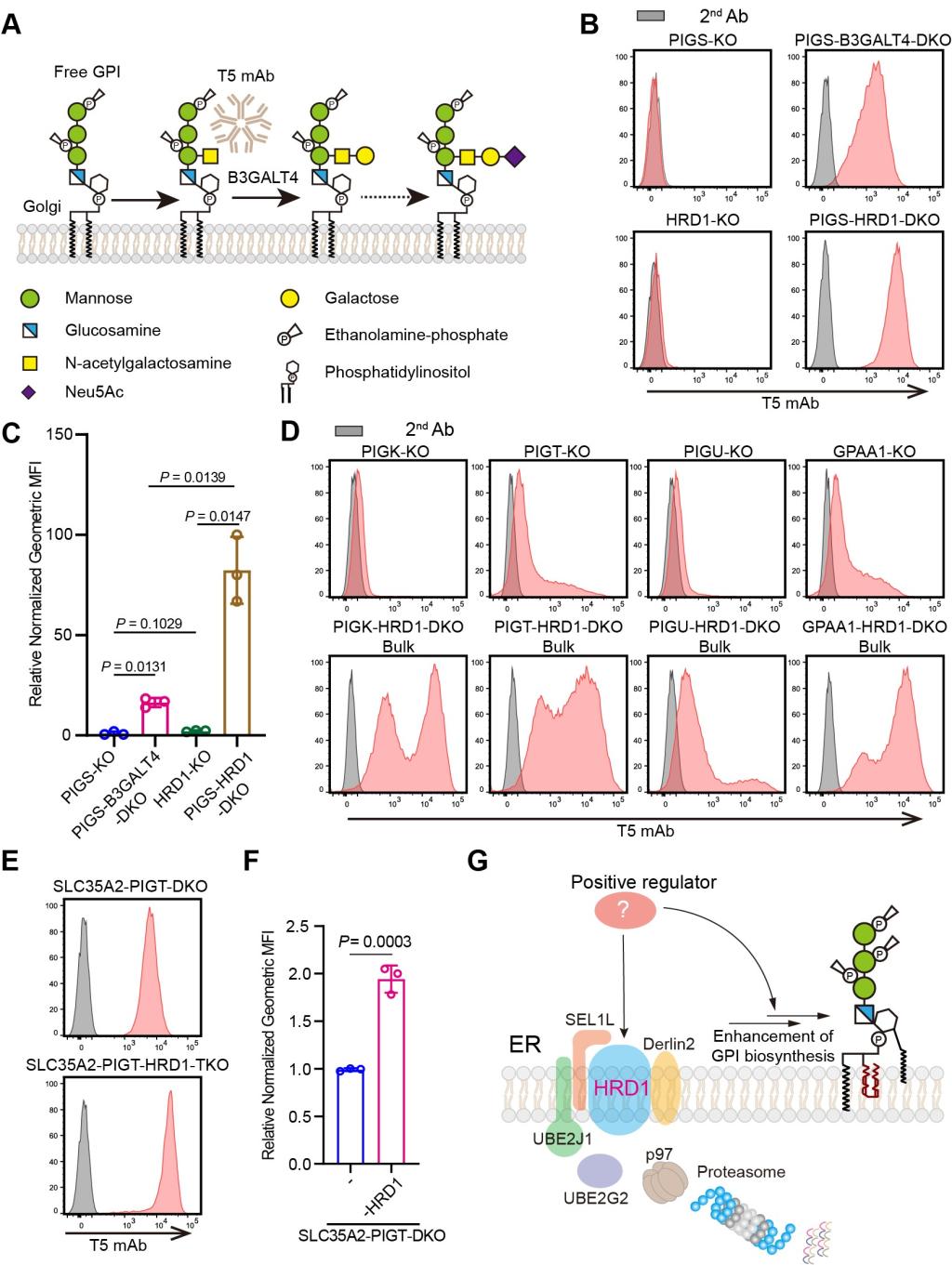
图1 ERAD-L的缺陷导致GPI的生物合成上调
进一步研究发现广泛表达的GPI锚定蛋白CD55前体和内质网驻留蛋白ARV1参与ERAD缺陷条件下GPI的上调。在GPI转酰胺酶缺陷的细胞中,GPI锚定蛋白前体无法获得GPI修饰,在C端保留未切割的GPI附着信号。ERAD活性缺失导致CD55前体的积累,进而上调GPI的生物合成。其中GPI附着信号肽是上调GPI合成的活性元件(图2)。为了确认GPI附着信号肽在GPI合成上调中的特异性,我们还对31种GPI锚定蛋白进行了测试,其中CD55、CD48和PLET1的GPI附着信号肽都可以增强GPI生物合成,同时ARV1是GPI上调的必要条件(图3)。
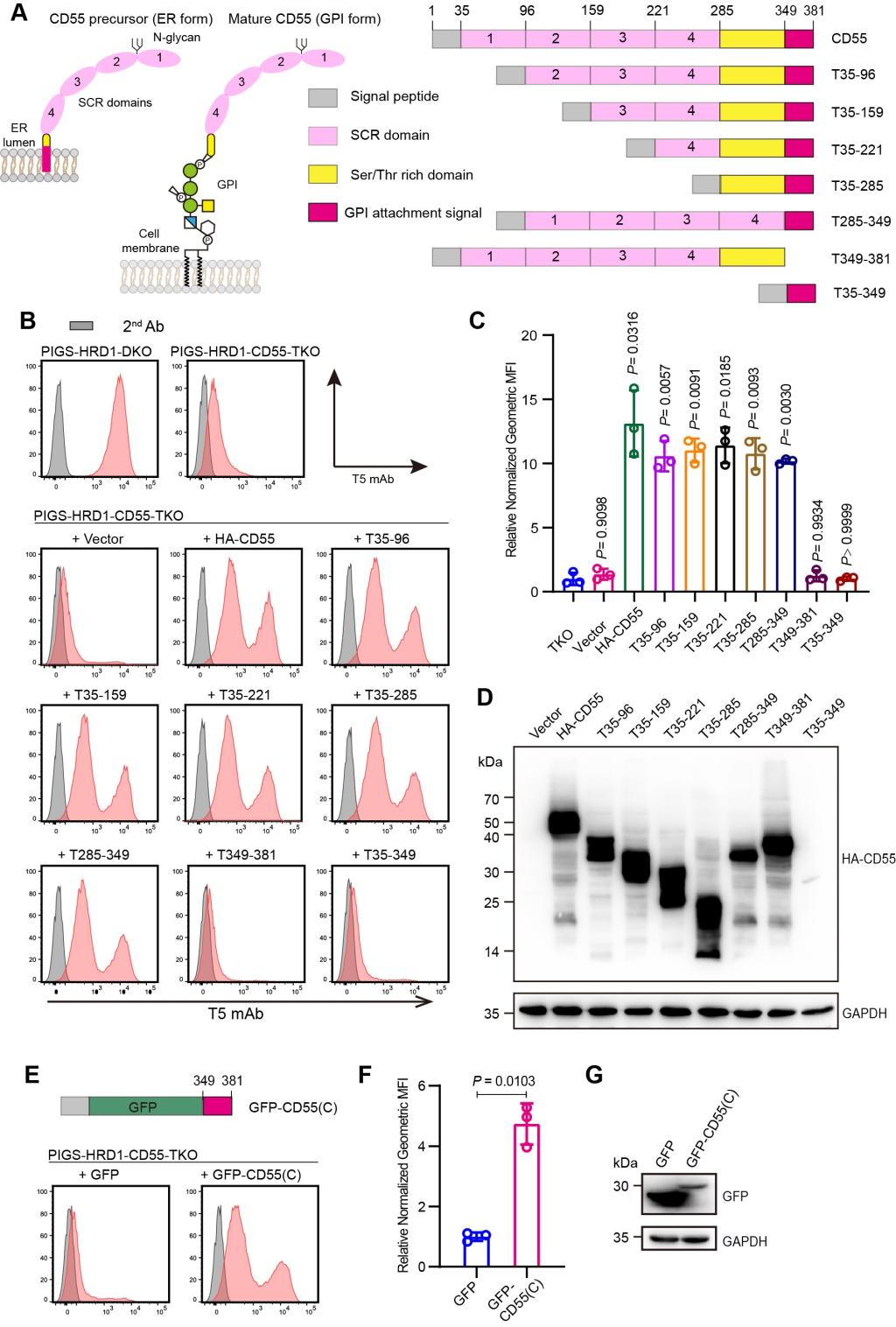
图2 GPI附着信号肽(CD55)的积累上调GPI的生物合成
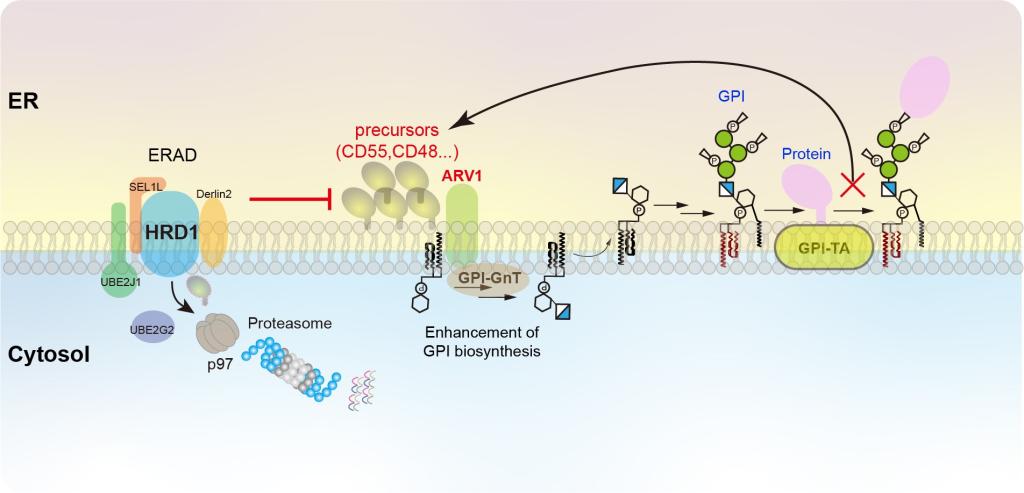
图3 GPI锚定蛋白生物合成反馈调节机制
本研究是中西秀树教授团队在细胞糖生物学研究方面一个新的突破,研究阐明了GPI锚定蛋白生物合成反馈调节的分子机制,为进一步研究GPI锚定蛋白异常表达,如癌症细胞中GPI锚定蛋白表达过量的现象提供重要线索。
我院青年教师柳艺石为论文第一作者,大阪大学王宜成博士为该论文的共同第一作者,我院原教授藤田盛久和大阪大学Taroh Kinoshita教授为该论文的共同通讯作者,作者还包括我院青年教师周小满和张琳培等人。上述研究工作得到了国家自然科学基金(31900923,32071278)、江南大学国际联合项目和中央高校基本科研计划(JUSRP121015)等项目的资助。
