近期,我校hjc356黄金城首页线路穆晓清团队在亮氨酸脱氢酶的定向进化中取得进展,研究成果“Enhanced catalytic efficiency and coenzyme affinity of leucine dehydrogenase by comprehensive screening strategy for L-tert-leucine synthesis”正式发表于Applied Microbiology and Biotechnology(IF=3.53)(https://doi.org/10.1007/s00253-021-11323-w)。
L-叔亮氨酸是合成抗癌和抗HIV蛋白酶抑制剂的重要手性中间体。由于其侧链叔丁基疏水性强的特点,它也被广泛用作不对称合成中有机催化剂的手性助剂。亮氨酸脱氢酶不对称催化三甲基丙酮酸合成L-叔亮氨酸这个反应途径,具有原子利用率高,副产物少等特点因而在工业生产L-叔亮氨酸中被广泛应用。目前工业生产中,影响L-叔亮氨酸生产成本有两大因素,即:细胞添加量和辅酶添加量。因此获得催化效率高,辅酶亲和力高的工程亮氨酸脱氢酶将具有良好的工业应用前景。
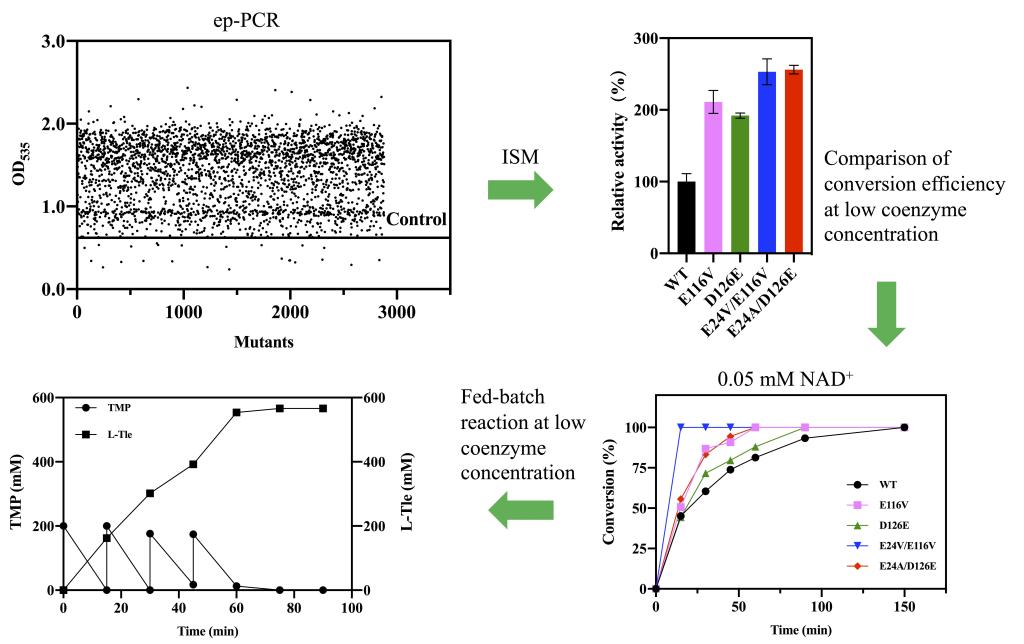
穆晓清团队在对亮氨酸脱氢酶的定向进化中使用了两种筛选策略。首先通过易错PCR寻找对亮氨酸脱氢酶催化效率有提升作用的关键残基,通过约3000株突变体筛选锁定了3个对催化效率起作用的关键点;然后在对三个关键点进行组合的过程中,运用了低辅酶浓度的筛选策略对迭代饱和突变文库进行了筛选,并获得了在低辅酶浓度条件下依然展现出高催化效率的突变组合。通过两步筛选,最终获得的突变组合E24V/E116V对底物和辅酶的亲和力分别提高了7.7倍和2.8倍,同时该突变株对底物的催化效率kcat/Km提高了5.4倍。在配合葡萄糖脱氢酶辅酶再生系统的反应体系中,该突变体在低辅酶浓度的条件下展现出较高的催化效率。当辅酶浓度为0.05 mM时,E24V/E116V的催化效率相比于野生型提高了10倍。在高浓度底物的转化实验中,存在显著的底物抑制现象。为了解除底物抑制的影响,本研究采取了分批补料的策略,在75分钟内实现了0.57 M底物完全转化。最终达到了22.8 mmol·h−1·L−1·g−1的比时空转化率,TTN高达11400。
图一.文章摘要图
穆晓清副教授和聂尧教授为该论文的共同通讯作者,2017级博士生周峰为该论文的第一作者。上述研究工作得到了江苏省研究生培养创新工程项目(KYCX19_1831)和国家自然科学基金项目(Nos.21336009, 21176103)的资助。
